Leuchter, Rudolf
et les bleus de Prusse
Richard J. Green
Traduction française de Franck Canorel (mars 2012)
Annexe II
L’effet du dioxyde de carbone sur le pH
Le dioxyde de carbone (CO2) est un anhydride d’acide, ce qui signifie que lorsqu'il est dissous dans l’eau, il abaisse le pH de la solution. L’eau de pluie pure a un pH de 5,6 en raison de la concentration atmosphérique de CO2, soit 360 ppm. Au cours de la seconde guerre mondiale, les concentrations atmosphériques de CO2 étaient plus proches de 330 ppm, mais ce n’est pas une différence importante pour ce que nous entendons démontrer ici. On peut considérer que le processus suit trois étapes qui toutes impliquent un équilibre chimique. La première étape est la dissolution du CO2 dans l’eau ; sa constante d’équilibre nous est donnée par la constante Khc de la loi de Henry :
CO2 + H2O <=> H2CO3
La deuxième étape est la réaction acido-basique entre l’acide carbonique et l’eau ; sa constante d’équilibre est noté ici Kc1 :
H2CO3 + H2O <=>H3O+ + HCO3-
La troisième étape est la réaction entre l’ion bicarbonate (HCO3-) et de l’eau dont la constante d’équilibre est ici notée Kc2 :
HCO3- + H2O <=>H3O+ + CO32-
En outre, il faut considérer l’autoprotolyse de l’eau :
2H2O <=> H3O+ + OH-
En solution aqueuse, on peut considérer la concentration de l’eau comme une constante et en tirer une constante de l’équilibre Kw. Ces constantes et leurs enthalpies associées sont présentées par Seinfeld1. Voici un tableau des quantités pertinentes :
| Tableau II - Constantes d’équilibre et enthalpies associées pour l’absorption du dioxyde de carbone par l’eau. |
||||
|---|---|---|---|---|
| Constante | Valeur | Enthalpie à 298 K (Kcal/mol) |
||
| Khc | 3.4 x 10-2 | -4.846 | ||
| Kc1 | 4.283 x 10-7 | 1.825 | ||
| Kc2 | 4.687 x 10-11 | 3.55 | ||
| Kw | 1.008 x 10-14 | 13.345 | ||
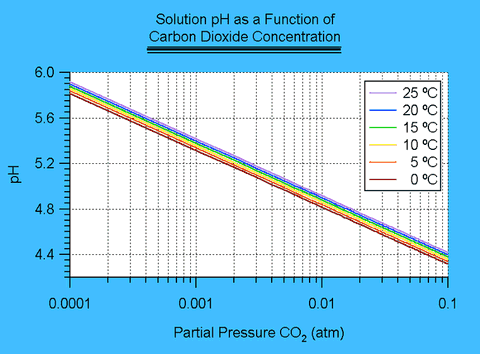
La dépendance légère de ces constantes vis-à-vis de la température peut être prise en compte par le biais des enthalpies données. Le pH d’une solution est défini comme-log [H+] où [H+] est la concentration d’ions hydronium en moles/litre. A partir des informations données, il est possible de déduire une équation cubique exprimant la relation entre [H+] et la pression partielle de CO2, PCO2. Cette équation est également présentée par Seinfeld1 :
[H+]3 - (Kw+KhcKc1 PCO2)[H+]-2+KhcKc1 Kc2PCO2=0J'ai résolu cette équation à l’aide d’un simple programme informatique utilisant une méthode similaire à celle de Newton. Les résultats sont présentés ci-dessous2 :
Figure II.1
![]()
Revenir à l'article Leuchter, Rudolf et les bleus de Prusse
Notes.
1. John H. Seinfeld, Atmospheric Chemistry and Physics of Air Pollution, John Wiley & Sons, New York, 1986, pp. 198-204.
2. Par exemple, voir William H. Press, Saul A. Teukolsky, William T. Vetterling, and Brian P. Flannery Numerical Recipes in C: The Art of Scientific Computing, Second Edition, Cambridge University Press, Cambridge, 1996.
[ Article | Germar Rudolf | Négationnisme et réfutations | Toutes les rubriques ]